2021真实世界研究报告:临床研究被数字化重构
随着精准医疗需求的不断提高,临床端的医生和患者对诊疗解决方案提出了越来越高的要求。医生和患者需要更加贴近临床使用情况的临床证据,来为患者的治疗方案制定提供更加具有指导意义的信息。
传统的随机对照研究方法此时表现出了自己的局限性。虽然随机对照试验可以得到在理想环境下更加准确的临床证据,但是对于更加广泛的真实世界环境中存在的复杂病例,却无法全部囊括。这使得随机对照试验虽然在检验药械产品的安全性和有效性上有突出的优势,但是对于实际临床诊疗过程中的临床决策环节却帮助有限。
在这样的情况下,真实世界研究逐渐成为了研究者们在临床证据的挖掘过程中使用的新方法,并进而随着政策的不断开放,而成为了药械产品全周期管理中不可获取的一环。我国的真实世界研究产业也随着临床共识和指导原则的不断完善,在国内掀起了一波新的浪潮。
那么,国内真实世界研究行业处于什么发展阶段,市场潜力如何,有哪些企业已经切入其中以及未来将迎来怎样的挑战和发展趋势?
为了弄清上述问题,蛋壳研究院通过对开展真实世界研究的企业进行广泛调研,结合自己的研究内容,撰写《2021真实世界研究行业报告——监管落地,从药品到器械全面应用》,试图从政策、市场、产业角色、典型案例、发展趋势等多维度全面解析真实世界研究行业,以期为行业参与者提供较为全面的行业信息。

核心观点
1.五大角色竞逐赛道,各自手握优势资源,但由于市场尚处于蓝海状态,竞争暂时不算激烈
2.数字化技术对临床研究的助力作用是产业质变的关键
3.应用场景重点聚焦上市后研究,对于新产品研发的助力作用有限
4.可以在部分场景中替代或辅助随机对照试验,同时也在药械产品全生命周期管理中产生更多新场景
5.随着监管指导原则的落地,产业逐渐成为药械企业刚需,即将迎来进一步扩容
6.行业尚未行至瓶颈期,但政策、合规、数据孤岛问题等多方面挑战,可能会在未来成为行业发展的掣肘
RWS、RWD与RWE
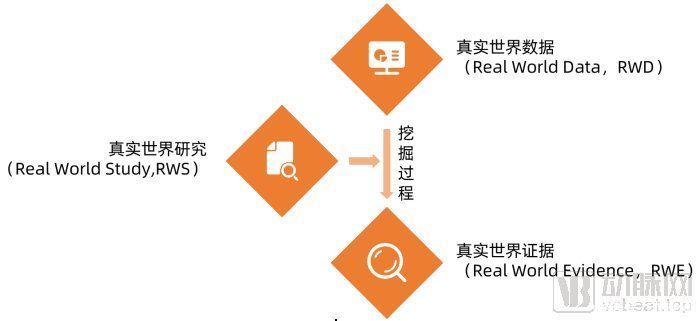
首先我们需要先厘清真实世界研究中最重要的三个概念,真实世界研究(RWS),真实世界数据(RWD)和真实世界证据(RWE)。考虑到目前已经有明确的政策发布,此处我们首先引用政策原文中对于真实世界研究、真实世界数据和真实世界证据的定义,再做进一步解释。
国家药品监督管理局(NMPA)在《真实世界证据支持药物研发与审评的指导原则(试行)》对真实世界研究的定义:真实世界研究是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程。
真实世界研究、真实世界数据和真实世界证据
真实世界数据(Real World Data,RWD)是在真实世界环境下收集到的与研究对象健康有关的数据。真实世界数据包括的维度十分广泛,从研究对象的生理指标,到生活习惯,再到全方位的诊疗情况、既往病史,都被包括在真实世界数据的范畴中。
真实世界证据(Real World Evidence,RWE)是通过对真实世界数据的研究,得出的与医疗产品的临床获益/风险相关的临床证据。这些临床证据可以直接表征在实际使用情况下、药品、医疗器械、手术方案等不同医疗解决方案对特定患者群体的获益和损害。
真实世界研究(Real World Study,RWS),则指的是从收集真实世界数据(RWD)开始,到产生真实世界证据(RWE)为止的整个研究过程。
因此真实世界研究的核心目的,就在于通过收集真实世界状态下的数据,并进行相应的分析,得出真实世界证据作为结论,用以辅助临床决策,或证明药物或医疗器械的临床价值。
全方位技术助力,真实世界研究体系完善化
