40分钟对话,一位一线临床主任眼中的永泰生物
本文来自 微信公众号“医药观澜”。
中国国家药监局药品审评中心(CDE)网站公示信息显示,截止8月31日,八月份共有11项药品上市申请纳入优先审评,涉及9款创新药,来自再鼎医药(ZLAB.US)、默沙东(MRK.US)、基石药业-B(02616)、荣昌生物等公司。根据纳入优先审评的理由划分,其中5款符合附条件批准,3款为临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药,另有1款为临床急需境外已上市境内未上市的罕见病药品。
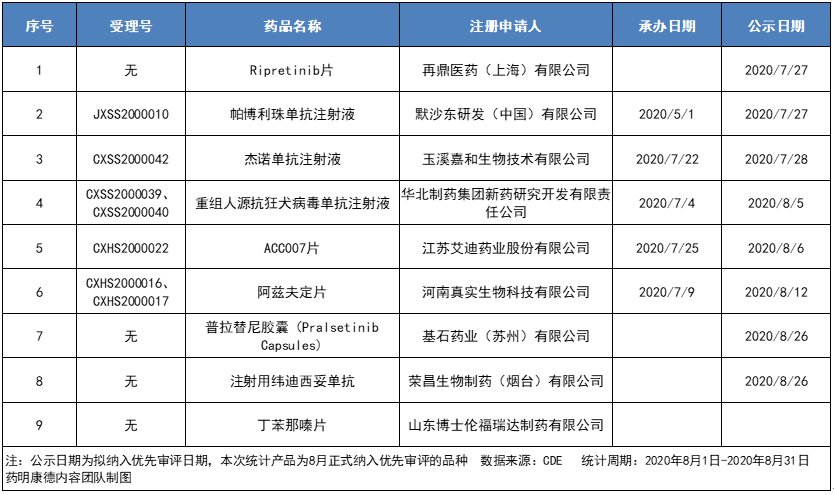
1、再鼎医药:ripretinib片药物作用机制/靶点:酪氨酸激酶开关控制抑制剂纳入优先审评理由:符合附条件批准的药品
Ripretinib是一种酪氨酸激酶开关控制抑制剂,通过使用独特的双重作用机制来调节激酶开关和活化环,从而广泛抑制KIT和PDGFRα突变激酶。此前,该产品已在美国、加拿大和澳大利亚获批上市。今年7月,CDE受理ripretinib的新药上市申请,用于治疗已接受过包括伊马替尼在内的3种或更多种激酶抑制剂治疗的晚期胃肠道间质瘤(GIST)成人患者。
根据一项名为INVICTUS的国际多中心3期临床研究,针对此前已接受过包括伊马替尼、舒尼替尼和瑞戈非尼治疗的129例晚期胃肠道间质瘤患者,ripretinib的客观缓解率为9.4%(vs 0%),中位总生存期为15.1个月(vs 6.6个月),且死亡风险降低了64%(危险比为0.36)。
2、默沙东:帕博利珠单抗注射液药物作用机制/靶点:PD-1单抗纳入优先审评理由:符合附条件批准的药品
帕博利珠单抗(Keytruda)是默沙东开发的重磅PD-1抑制剂,此前已在中国获批5项适应症,涉及癌种有黑色素瘤、鳞状/非鳞状NSCLC、PD-L1表达阳性NSCLC,以及食管鳞状细胞癌。根据CDE官网,此次纳入优先审评的是Keytruda在中国提交的第六项上市申请,适应症可能为晚期肝细胞癌(HCC)一线治疗。
在一项名为KEYNOTE-524/study116的1b期试验中,Keytruda联合口服多受体酪氨酸激酶抑制剂仑伐替尼对于未接受系统治疗的不可切除晚期肝细胞癌患者达到具有临床意义的总缓解率,ORR达到36%,中位DOR达到12.6个月。
3、嘉和生物:杰诺单抗注射液药物作用机制/靶点:PD-1单抗纳入优先审评理由:符合附条件批准的药品
杰诺单抗(geptanolimab)是一种靶向免疫细胞PD-1的人源化IgG4单克隆抗体,嘉和生物拥有核心知识产权。据介绍,杰诺单抗可通过选择性阻断双重配体(PD-L1和PD-L2),恢复免疫系统识别和杀死癌细胞的能力,拟开发用于治疗多种晚期实体瘤。此次纳入优先审评的是该产品在中国提交的首个新药上市申请(NDA),适应症为治疗复发或难治性外周T细胞淋巴瘤(PTCL)。
根据今年美国癌症研究协会(AACR)上公布的单臂2期临床试验数据数据,杰诺单抗治疗复发和难治外周T细胞淋巴瘤有显著的疗效:IRC评估的ORR为36.3%,PTCL主要亚型均能获益,其中ALK阴性间变大细胞淋巴瘤ORR可达58.3%;此外,既往接受西达本胺治疗失败的受试者仍有33.3%获得缓解。4、华北制药:重组人源抗狂犬病毒单抗注射液药物作用机制/靶点:可直接中和体内狂犬病毒纳入优先审评理由:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药
重组人源抗狂犬病毒单抗注射液(rhRIG)是华北制药集团新药研究开发公司自主创新项目,其作用机制及适应症为:与人用狂犬病疫苗联用,用以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其它狂犬病毒易感动物咬伤、抓伤患者的被动免疫。
根据华北制药公告,该项目曾在今年4月取得3期临床试验报告,结论为:重组人源抗狂犬病毒单抗注射液联合人用狂犬病疫苗对III级疑似狂犬病毒暴露人群的暴露后预防达到主要疗效和次要疗效终点,且安全性良好,达到方案设定目标,试验药物是安全、有效的。
5、艾迪药业:ACC007片药物作用机制/靶点:全新一代非核苷类逆转录酶抑制剂纳入优先审评理由:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药
ACC007是艾迪药业开发的全新一代非核苷类逆转录酶抑制剂,通过非竞争性结合并抑制HIV逆转录酶活性,从而阻止病毒转录和复制