CAR-T疗法的临床研究和市场分析
2017年被业内称为CAR-T (Chimeric Antigen Receptor T cell)疗法的元年,FDA共批准了两款CAR-T产品,分别是Novartis的Kymriah和Kite/Gilead的Yescarta。新疗法如CAR-T疗法的高速发展,表明我们正站在战胜癌症的关键阶段。
CAR-T疗法的两大先驱
目前市场上的两款CAR-T产品,Kymriah和Yescarta分别获批于2017年8月和10月。
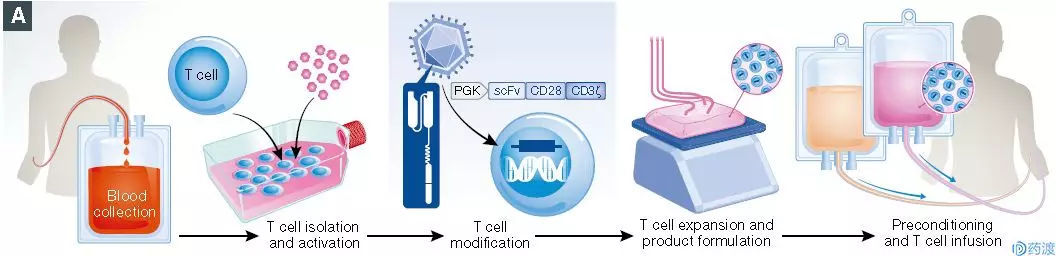
图一 CAR-T疗法的开发流程 (参考文献2)
Kymriah
根据一项单臂二期临床试验(ELIANA),FDA授予了Kymriah优先评审和突破性疗法资格,并在6个月内批准其用于治疗难治性、或者复发的B细胞前体急性淋巴细胞白血病(ALL)的儿童和青少年患者,适用年龄达到25岁。该二期试验中患者在接受三个月的注射治疗后,完全缓解率(CR)与不完全血细胞计数恢复率(ORi)之和达到83%。FDA对其的规范审查还包括治疗成人难治性、或者复发的弥漫大B细胞淋巴瘤(DLBCL)和恶性非霍奇金淋巴瘤(NHL)。欧洲也有相似的疾病临床研究。除此之外,Kymriah还接受了用于滤泡性淋巴瘤(FL)治疗、DLBCL二线疗法、慢性淋巴细胞白血病(CLL)和多发性骨髓瘤(MM)治疗的评价。
Yescarta
另一款疗法Yescarta被FDA批准用于治疗已接受过化疗的难治性、或者复发的B细胞淋巴瘤成人患者,包括DLBCL和其他恶性NHL。Yescarta在一项单臂二期临床试验(ZUMA-1)中,患者的总缓解率(ORR)达到82%,其中CR占比58%。其早期数据显示治疗成人难治性、或者复发的B细胞ALL效果良好,多项关键临床正在评估其对套细胞淋巴瘤(MCL),包括FL在内的NHL亚型的治疗能力。
细胞因子释放综合征(CRS)
患者在接受Kymriah或Yescarta的治疗前,都需要经过严格的风险评估和应对策略的制订,以避免CAR-T疗法已知的不良反应--细胞因子释放综合征(CRS)。这是一种由于T细胞活性过度刺激引发的不良反应。同时,FDA还要求两家公司对这两款产品进行上市后研究,评估长期安全性和继发性恶性肿瘤的风险。
CAR-T疗法的后来者
除了已经进入市场的Kymriah和Yescarta,更多的CAR-T疗法研发管线和临床研究正在进行中,在不远的将来,我们会看到更多的安全性提升,新抗原靶向,甚至能够治疗实体瘤的成品CAR-T疗法问世。
JCAR017
Juno Therapeutics的JCAR017计划在2018年递交上市申请,其被认为将是Kymriah和Yescarta的强有力竞争者。目前正处于治疗难治性、或者复发的DLBCL一期临床阶段,靶向也是CD19。
数据表明其3个月治疗的ORR为74%,CR为68%;6个月治疗的ORR和CR均达到50%,并且不良反应的可控性更好。
UCART19
除了Juno的JCAR017,Cellectis和Pfizer联合研发的通用CAR-T产品UCART19也很被看好,更多管线见图二。
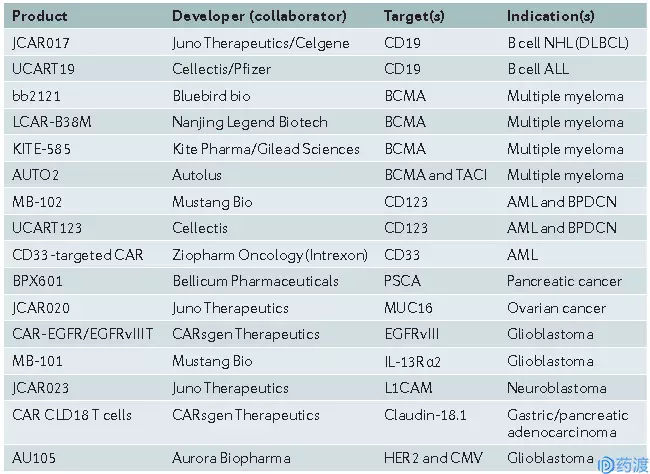
图二 目前部分处于临床一/二期研究的CAR-T疗法 (参考文献1)
在研的CAR-T疗法发展方向
在研的CAR-T疗法发展方向呈现在三个方面:血液细胞的新靶点,调控基因提高安全性,实体瘤治疗。
1. 血液细胞的新靶点
血液细胞新靶点研究可以进一步提高CAR-T疗法的靶向性,以Bluebird bio/Celgene的bb2121为例,其利用多发性骨髓瘤(MM)细胞特有的成熟B细胞抗原(BCMA),而非靶向正常细胞和肿瘤细胞共有的CD19来提高治疗效果。临床研究显示,bb2121治疗已化疗患者的ORR达到94%,CR为56%,毒性明显降低。FDA已授予bb2121突破性疗法,EMA也给予其优先级药品资格认定。南京传奇的LCAR-B38M,Gilead的KITE-585,Autolus的AUTO2均采用相似方式改进疗法,临床效果显著。
除了BCMA靶向,CD123在包括急性髓性白血病(AML)的血液恶性肿瘤中广泛表达。靶向CD123的研发管线包括Mustang Bio的MB102和Cellectis的UCART123,两者均处于治疗难治性AML和母细胞性浆细胞样树突细胞肿瘤的一期临床研究。特别要提到的是,Cellectis 的UCART123利用健康人T细胞来开发同种异体的CAR-T疗法,通过修饰T细胞来避免抗宿主反应,如果成功开发出CAR-T成品,将具有生产和使用更方便,并能降低成本的优势。虽然其临床一期研究因为一例患者死亡而被FDA暂时叫停,但是通过修改临床方案降低给药剂量,将很快继续开展。Cellectis还在开发其他靶向CD19、CD22、CD38和CS1的CAR-T疗法。
2. 提高安全性
制约CAR-T疗法发展的一个主要障碍就是不良反应。通过调控基因可以提高CAR-T疗法的安全性,Ziopharm Oncology公司正在开发一款靶向CD33的治疗方法,可以利用小分子来停止CAR的表达,其治疗AML的临床一期试验正在进行中。Bellicum Pharmaceuticals的BPX-601靶向前列腺干细胞抗原(PSCA),目前正在进行针对PSCA阳性的不可切除胰腺癌,其CAR只有在与PSCA和另一个小分子同时结合时才被激活。
3. 治疗实体瘤
CAR-T疗法能否对抗实体瘤还充满不确定性,需要解决的问题有抗原的异质性、难以透过基质和免疫肿瘤的微环境。Juno尝试开发了一款靶向粘蛋白16的产品JCAR020,利用白介素-12来刺激T细胞,相关研究还在进行中。
未来市场分析
目前两款CAR-T疗法,Kymriah的治疗费用约47.5万美元,Yescarta则是37.3万美元,从价格上重新定义了肿瘤治疗。到2026年,NHL(DLBCL,FL,MCL和CLL)和MM的治疗费用总和将超过200亿美元,其中CAR-T的销售额(欧美主要市场)约为11亿美元(图三)。
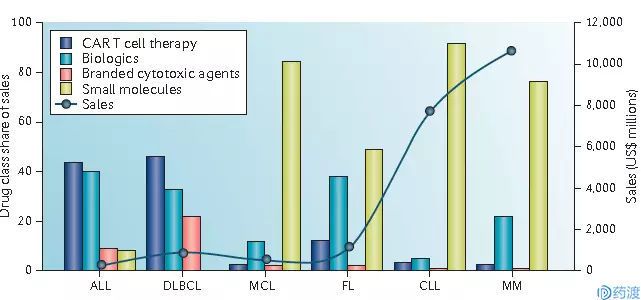
图三 2026年CAR-T疗法市场销量预测(欧美主要市场(参考文献1)
备注:ALL,急性淋巴细胞白血病;DLBCL,弥漫大B细胞淋巴瘤;MCL,套细胞淋巴瘤;FL,滤泡性淋巴瘤;CLL,慢性淋巴细胞白血病;MM,多发性骨髓瘤。
CAR-T疗法预计将占青少年和儿童ALL(44%)及DLBCL(46%)治疗的主要部分。而考虑到JCAR017较已上市两款产品的药效和安全性优势,其市场占有率将大幅提高并很可能独占CLL的CAR-T治疗市场。考虑到CAR-T疗法常用于多次化疗患者,治疗群体小,我们将其暂定义为ALL和NHL的三线疗法,MM的四线疗法,bb2121应该做为MM的四线治疗,所以市场占有率很小。当然,CAR-T疗法的安全性也是影响其市场销售额的一大问题。
CAR-T疗法总体还处于发展初期,治疗潜力巨大,市场前景广泛。特别是在不断改进之后,无论是通用型成品CAR-T疗法(不再需要从每一例患者体内采集T细胞),或是能够突破实体瘤治疗瓶颈的CAR-T疗法,前途都将不可限量。
参考文章:
The market for chimeric antigen receptor T cell therapies, NatureReviews Drug Discovery.
Clinical development of CAR T cells-challenges and opportunities intranslating innovative treatment concepts, EMBO Molecular Medicine.
作者:做药的土豆